XÉNOTRANSPLANTATION : L’urgence de prioriser des alternatives plus éthiques
Prioriser des alternatives plus éthiques à la xénotransplantation
Grâce aux avancées de la médecine et des biotechnologies, la transplantation d’organes joue maintenant un rôle essentiel pour sauver et améliorer la qualité de nombreuses vies humaines. L’agence de la biomédecine estime qu’une quinzaine de greffes ont été effectuées chaque jour en France en 2023 [1]. Cependant, il est estimé qu’environ 19 personnes meurent chaque jour en Europe en attente d’un organe [2]. Alors que le besoin ne cesse d’augmenter, la pénurie mondiale d’organes humains représente un réel défi pour la recherche biomédicale et la santé publique. Un éventuel moyen de pallier le problème de pénurie est la transplantation d’organes provenant d’animaux, ce que l’on appelle « xénotransplantation, XTP, ou encore xénogreffe ».
Dans cet article, nous verrons comment et pourquoi la science s’est intéressée à cette pratique. Nous discuterons des enjeux et limites de la XTP puis nous explorerons les raisons pour lesquelles il est urgent de se focaliser sur des nouvelles approches scientifiquement prometteuses, plus éthiques et durables.
Une approche scientifiquement et éthiquement discutable
L’idée de transplanter des organes animaux chez l’homme est très ancienne. Les premières tentatives de xénotransplantation chez l’humain ont lieu au début du XXe siècle et se soldent par des échecs. À l’époque, les médecins connaissent peu le fonctionnement du système immunitaire et ne comprennent pas les mécanismes de rejet contribuant à l’échec des opérations. En 1984, la XTP a été portée à la connaissance du public de façon particulièrement dramatique avec le cas de « Baby Fae », un nouveau-né humain de 15 jours qui reçut le cœur d’un babouin lors d’une opération effectuée en Californie. Le bébé a survécu vingt jours seulement après la chirurgie [3]. Cet épisode a ébranlé la communauté scientifique et provoqué un débat sur les conséquences sanitaires et éthiques de telles opérations.
Bien que cette « percée » ait été sans lendemain immédiat, la technologie des xénogreffes a tout de même fait depuis l’objet de nombreuses études. Au cours des années 1990, les scientifiques ont commencé à mieux comprendre le fonctionnement du système immunitaire et les mécanismes moléculaires sous-jacents au phénomène de rejet. On sait aujourd’hui que les cellules immunitaires reconnaissent les molécules situées à la surface des cellules propres à chaque individu et distinguent le « soi », les cellules qui portent les bons marqueurs, et le « non-soi », celles qui porte des marqueurs différents, qui poussent notre système immunitaire à attaquer et détruire toute cellule ou organe étranger. C’est ainsi qu’est venue l’idée de manipuler génétiquement les animaux pour contourner le système immunitaire humain et rendre leurs organes davantage compatibles avec notre organisme. Le porc est devenu l’espèce de prédilection par rapport aux primates non humains (PNH) car il est plus facile d’accès, ses organes sont anatomiquement proches de l’homme, il a une maturité reproductive et une gestation plus courtes et une progéniture plus nombreuse, ce qui fait qu’il est plus adapté aux manipulations génétiques. De plus, son utilisation soulève moins de préoccupations éthiques puisqu’il est déjà employé pour l’alimentation humaine [4].
Les progrès scientifiques en matière d’immunologie et d’édition de gènes (avec des technologies telles que le clonage ou CRISPR/Cas9) ont permis d’espérer un meilleur succès avec les organes de porcs préalablement modifiés génétiquement, afin d’éviter le rejet. Cependant et malgré ces efforts, toutes les XTP avec des organes entiers se sont soldées par des échecs sur l’humain. Aux problèmes immunologiques s’ajoutent d’autres limites physiologiques qui semblent rarement discutées comme la durée de vie (15 ans environ) et la température corporelle du porc (39 degrés). Ainsi, les nombreuses recherches sur les moyens de surmonter les mécanismes de rejet pourraient être complètement entravées par le vieillissement rapide de l’organe greffé ou le mauvais fonctionnement des enzymes porcines à 37 degrés [5]. Cela serait particulièrement grave pour les personnes peu âgées, qui ont le plus grand intérêt à recevoir un organe pérenne. Aucune donnée n’est accessible quant à la dégradation des tissus et le temps de survie réel de l’organe porcin après une XTP.
L’importance de la qualité de vie par rapport à une simple prolongation est à prendre en compte également dans l’équation, étant donnée qu’actuellement toutes les personnes ayant subi une XTP ont vécu dans des conditions de vie extrêmement difficiles (traitements immunosuppresseurs lourd avec des risques élevés d’infections, de cancer etc). Le corps humain a naturellement des mécanismes pour éviter le développement de corps étrangers (cellules, virus, bactéries) qui pourraient nuire au fonctionnement de l’organisme. De ce point de vue, n’est-il pas contre-productif voire dangereux de tenter à tout prix de contourner ces systèmes de protection naturels ? En 2022 et 2024, la fin tragique des patients au mieux deux mois après leurs xénogreffes de cœur ou de reins de porc ne peut que confirmer ces propos. Malgré l’optimisme — semble-t-il exacerbé — des médias et de la presse scientifique, la réalité est telle que la science est loin de pouvoir réaliser ce genre d’« exploit » [6],[7].
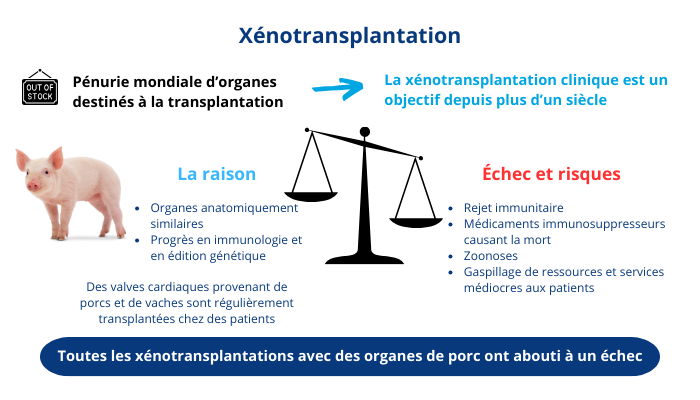
Schéma récapitulant la situation actuelle de la XTP
Au-delà d’être dangereuse, voire létale pour le patient, la XTP comporte également un véritable risque sociétal pour la santé humaine globale en permettant la transmission de virus inter-espèce, à l’origine des zoonoses. En effet, les receveurs étant sous immunosuppresseurs pour éviter le rejet, le risque d’infection par des maladies animales issues du greffon est accru. Une fois dans le corps du patient, l’agent pathogène peut non seulement le tuer, mais également muter jusqu’à devenir transmissible pour l’homme, et potentiellement générer des pandémies. Le degré de risque de propagation est aujourd’hui méconnu car trop peu d’essais cliniques ont été effectués, il est donc impossible d’exclure la possibilité qu’un nouvel agent pathogène soit transféré du porc à l’homme à la suite d’une XTP [8]. Et l’histoire montre que ces inquiétudes sont vérifiées : un récent rapport de MIT Technology Review, mentionne la présence d’un virus porcin dans le corps du premier patient à recevoir une xénogreffe cardiaque qui est décédé deux mois après, très probablement à cause du virus. La société biotechnologique Revivicor ayant fourni le cœur de porc génétiquement modifié s’est refusée à tout commentaire [9].
L’humanité a déjà expérimenté à plusieurs reprises les effets néfastes de diverses maladies zoonotiques (SIDA, Covid-19, Variole du singe…), et il semble manifestement peu judicieux d’ouvrir sans plus de réflexions préalable une toute nouvelle voie de transmission des maladies inter-espèces. En ce sens, la xénotransplantation ne concerne pas simplement médecins, patient(e)s et proches mais bien l’ensemble de la société. Il serait donc important et nécessaire d’établir un bilan entre bénéfice individuel, coûts et risques collectifs. Le bien-fondé de la XTP ne peut se discuter qu’au sein d’un débat à l’échelle internationale, car on parle ici de risque de pandémie, pour aboutir à des lois et des directives strictes, raisonnables et éthiques.
Opinion public et questions bioéthiques
Les enjeux liés à la xénotransplantation sont multiples. Nous avons déjà évoqué les questions d’ordre sanitaire, scientifique et éthique. Ces dernières engendrent inévitablement un débat public, essentiellement institutionnalisé, autour de la justification et l’implémentation de cette approche.
Peu de données objectives existent à l’heure actuelle sur la réaction de la population à la question de la XTP. Une étude publiée dans Nature à la fin des années 90 montre qu’il existait déjà de grandes divergences d’opinion entre les scientifiques développant et pratiquant la XTP, et les autres membres du corps médical ou du grand public [10].
Deux barrières sociales majeures à la XTP peuvent être identifiées :
- La morale ou la raison : accepter la XTP serait faire preuve de spécisme, accepter le droit que certains humains s’octroient de sacrifier des animaux pour bénéficier de leurs organes. Se pose aussi la question de l’instrumentalisation, considérant l’animal comme un outil que l’on peut modifier à sa guise [4]. Contrairement aux humains, les animaux ne peuvent pas donner leur consentement. De plus, la fabrication d’organes animaux génétiquement modifiés nécessite des installations et protocoles spécifiques entravant le bien-être des animaux. Il y a ici une réelle question bioéthique concernant le respect de la dignité humaine et du bien-être animal ; jusqu’où l’humain est-il prêt à aller pour espérer prolonger la vie des individus de son espèce ? [11] Cette approche est-elle bien raisonnable connaissant tous les risques (directs ou indirects) de souffrance humaine et animale associés ?
- La peur : le manque de confiance en cette approche qui n’a jamais fait ses preuves , il existe un inconfort psychologique à accepter de porter un organe provenant d’un animal d’une autre espèce (le franchissement de la barrière inter-espèce). En ce sens, au-delà des craintes de souffrir physiquement voire succomber suite à l’opération, les témoignages laissent apparaître une résistance associée à une peur de perte d’identité [12]. La XTP et les modifications génétiques faites sur l’animal soulèvent aussi l’hypothèse que les animaux acquièrent des caractéristiques humaines ou le contraire.
En 2023, une enquête sur plus de 5000 personnes a été menée aux Etat-Unis. 64% ont dit ne pas être ouvert(e)s à la xénotransplantation expérimentale même si elle permet de prolonger leur vie [13]. Ainsi, il semblerait que l’opinion publique n’ait pas vraiment changé au cours de ces 30 dernières années, malgré l’engouement de la presse et de certains scientifiques soutenant que la XTP sera bientôt une réalité pour la santé humaine [14], [15].
Même si les barrières scientifiques et les risques sanitaires étaient surmontées, l’acceptation de la XTP par la société resterait un problème de taille qui peut faire que cette pratique ne soit jamais une réalité.
Des alternatives prometteuses et plus éthiques
En 1995, le pionnier de la transplantation d’organes Sir Roy Calne a déclaré que la xénotransplantation « est au coin de la rue , mais il se peut que ce soit un très long chemin » [16]. Trente ans plus tard, aucune xénotransplantation a permis de sauver la vie d’un être humain. Mais quelle autre méthode pourrait permettre la production d’organes humains fonctionnels à l’extérieur du corps, le « Graal » de la médecine régénérative recherché depuis si longtemps ?
À l’ère de l’explosion d’outils (bio)technologiques toujours plus complexes et innovants, plusieurs solutions alternatives existent, notamment la bio-impression 3D/4D et les organoïdes.
Les scientifiques utilisent une encre bio-compatible (comme le collagène), des cellules saines de futurs receveurs, et une imprimante 3D pour assembler des tissus ou des organes. Selon le Dr Luciano Vidal, médecin et cofondateur de la biotech française de médecine régénérative HealShape, on pourrait transplanter des organes complètement bio-imprimés dans 8 ans [17].
De nouvelles recherches menées par le Wyss Institute et la School of Engineering and Applied Science (SEAS) de Harvard aux État-Unis permettent de faire un grand pas en avant vers la réalisation de cette quête [18]. Les chercheurs ont mis au point une nouvelle méthode de bio impression 3D, le SWIFT coaxial (co-SWIFT), qui récapitule l’architecture multicouche des vaisseaux sanguins natifs [19]. Non seulement ces vaisseaux biomimétiques présentent les caractéristiques des vaisseaux sanguins humains, mais après cinq jours de perfusion avec un fluide imitant le sang, les blocs de construction des organes cardiaques ont commencé à battre de manière synchrone, signe que le tissu cardiaque est sain et fonctionnel.
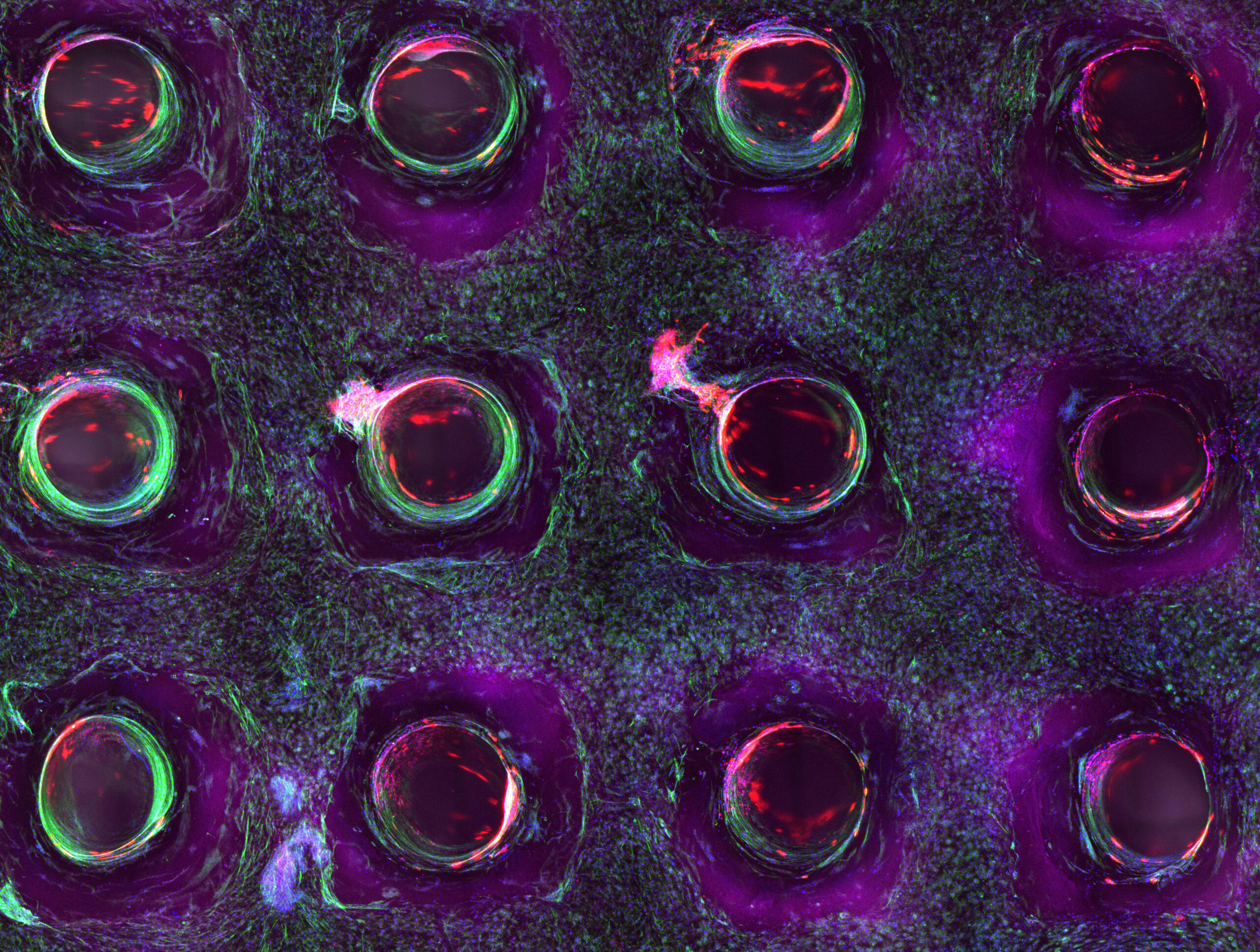
Bio-impression 3D de tissu vivant © Wyss Institute at Harvard University
Les organoïdes, ces structures complexes en 3D formées de multiples types cellulaires dérivés de patient(e)s pourraient également un jour servir de source d’organes alternative pour la transplantation. Ainsi, des chercheurs américains du Center for Stem Cell and Organoid Medicine (CuSTOM) envisagent des essais cliniques de transplantation de tissus organoïdes chez des patients souffrant de problèmes intestinaux [20].
La bio impression 3D et les organoïdes présentent de nombreux avantages. Une biocompatibilité parfaite, avec des organes produits à partir des propres cellules des patient(e)s. Le risque de rejet est donc bien moindre, sans nécessité d’utiliser des cocktails d’immunosuppresseurs, ce qui rendrait la procédure moins lourde et augmenterait ses chances de survie dans des conditions optimales. Ces méthodes ne posent aucun risque de pandémie ni de problèmes éthiques ou bioéthiques et présentent des avantages économiques certains, bien que difficiles à évaluer à l’heure actuelle.
Conclusion
Avec l’essor de nouvelles biotechnologies qui garantissent un meilleur succès et de moindres risques pour l’humain, on peut se demander quel est l’intérêt de continuer à investir du temps, de l’argent, mais aussi et surtout à imposer des souffrances physiques et psychologiques à des vies humaines et animales dans un processus dont les inconvénients scientifiques et éthiques sont si évidents et les probabilités de succès minimes. L’avenir des nouvelles technologies est tel que nous pourrions disposer d’organes fonctionnels à la demande, adaptés au corps des patient(e)s, dans un délai défiant toutes les statistiques actuelles [21].
Il est clair que ces nouvelles techniques nécessitent encore beaucoup de recherche et d’exploration. Les experts en transplantation sont impatients de disposer de plus de données pour faire de ces nouvelles opportunités une réalité. Ainsi, l’énorme investissement actuel d’argent et de temps pour la recherche sur la XTP a d’autant moins de sens et devrait être plutôt alloué à ces nouvelles approches qui sont maintenant possibles, moins risquées et donc plus désirables. L’enjeu de la pénurie d’organes est de taille et il en relève de la responsabilité des institutions et de la communauté scientifique de consacrer bien plus de temps et de ressources dans ces solutions plus éthiques et durables, à la hauteur des enjeux de notre siècle.
|
Définition et Historique [22] Le terme « xénotransplantation » est composé de la racine grecque « xeno » qui signifie « étranger », et du mot latin « transplantatum » signifiant « arraché de sa place et replanté ailleurs ». Faisant initialement référence aux plantes, le terme transplanter s’est élargi à l’organe dans le cadre de la médecine « greffer dans un organisme vivant un organe prélevé sur un autre individu ».
|
Références
[1] Le rapport médical et scientifique du prélèvement et de la greffe en France (2023).
[2] Journée européenne du don d’organes, de tissus et de cellules.
[3] Bailey LL et al., « Baboon-to-human cardiac xenotransplantation in a neonate » JAMA. 1985 Dec 20;254(23):3321 – 9.
[4] Catherine Rémy, « Le cochon est-il l’avenir de l’homme ? », Terrain, 52 | 2009, 112 – 125.
[5] Dooldeniya MD, Warrens AN. « Xenotransplantation : where are we today ? » J R Soc Med. 2003 Mar;96(3):111 – 7.
[6] Quentin Haroche, « Décès du deuxième homme greffé d’un cœur de porc », JIM 2023 7 Novembre.
[7] Smriti Mallapatyn, « First pig liver transplanted into a person lasts for 10 days », Nature 627, 710 – 711 (2024).
[8] Fishman Jay A. et al., « Xenotransplantation-associated infectious risk : a WHO consultation », Xenotransplantation. 2012 Mar-Apr;19(2):72 – 81.
[9] Antonio Regalado, « The gene-edited pig heart given to a dying patient was infected with a pig virus », MIT Technology Review 2022 4 Mai.
[10] Mohacsi, et al., « Aversion to xenotransplantation », Nature 378, 434 (1995).
[11] SHAW D. et al., « Ethical issues surrounding the transplantation of organs from animals into humans », Scientific & Technical Review. 2018 04 1 ; 37(1): pp. 123 – 129.
[12] Julie Lesage, « Les enjeux éthiques et juridiques de la xénotransplantation », Village de la Justice (2022) 14 Fév.
[13] Padilla Luz A, et al., « Public attitudes to xenotransplantation : A national survey in the United States », American Journal of Transplantation (2024) July 23.
[14] « Xénotransplantation : pour la 1re fois, la réponse immunitaire après la greffe de reins de porcs génétiquement modifiés chez l’humain est décryptée », Communiqué de Presse INSERM, (2023) 18 Août.
[15] Vadori M, Cozzi E., « Current challenges in xenotransplantation », Curr Opin Organ Transplant. 2024 Jun 1;29(3):205 – 211.
[16] Cooper DK., « A brief history of cross-species organ transplantation », Proc (Bayl Univ Med Cent). 2012 Jan;25(1):49 – 57.
[17] Luciano Vidal, « La bio-impression 3D, une révolution pour la médecine régénérative », TEDxRennes, YouTube (2023).
[18] Stankey, Paul P et al. « Embedding Biomimetic Vascular Networks via Coaxial Sacrificial Writing into Functional Tissue », Advanced materials (Deerfield Beach, Fla.) vol. 36,36 (2024): e2401528.
[19] Lindsay Brownell, « 3D-printed blood vessels bring artificial organs closer to reality », Wyss Institute at Harvard University, (2024) August 7.
[20] Science/AAAS Custom Publishing Office, « Organoids : Today’s research tool, tomorrow’s organ transplant solution », Science (2024) March 15.
[21] Brian Kateman, « Pigs aren’t the future of organ tranplants — stop acting like they could be », Fast Company (2024) May 20.
[22] Cooper DKC, et al., « A brief history of clinical xenotransplantation. Int J Surg », 2015 Nov;23(Pt B):205 – 210.
Rédigé par Dr Lilas Courtot, Responsable scientifique — Comité scientifique Pro Anima
Avec la contribution de Julia Fernandez, médiatrice scientifique — Université de Bordeaux
Crédits image : Futuro Prossimo (bandeau), Comité Pro Anima (image 1), Wyss Institute — Harvard University (image 2)