Dr Nicolas Aznar — Projet Nexpocan
Lauréat du Prix DVES 2023 - Catégorie Prix du Jury
SES108 — Mars 2023Docteur en biologie moléculaire et cellulaire et en biologie du cancer de l’Université́ Lyon I, chercheur CNRS au Centre de Recherche en Cancérologie de Lyon, Nicolas Aznar travaille sur une nouvelle génération d’organoïdes dont il nous explique les avantages et les enjeux.

Comité Pro Anima : Le Comité scientifique Pro Anima et la Fondation Descroix-Vernier ont été absolument ravis de vous remettre le Prix Descroix-Vernier EthicScience 2023 dans la catégorie Prix du Jury pour votre projet « NEXPOCAN. Nouvelle génération d’organoïdes dérivés de patients pour une meilleure modélisation du cancer ».
Pourriez-vous présenter en quelques mots, pour nos lecteurs, votre projet, ses particularités, les objectifs et résultats (en matière et/ou d’application) que vous attendez et sous quelles échéances ?
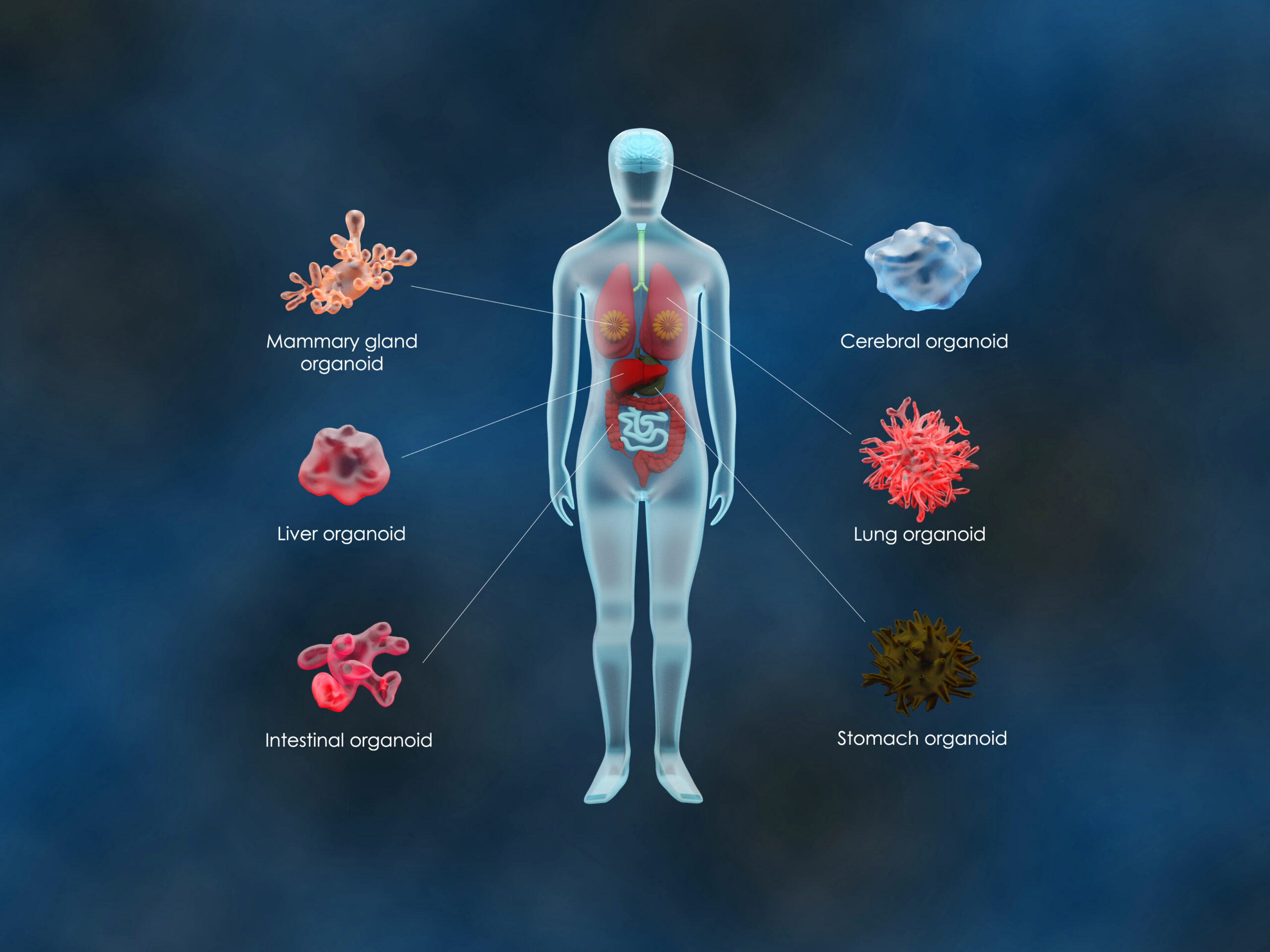
Dr. Nicolas Aznar : Les cellules souches (CS) et leur culture en 3 Dimensions (3D), aussi appelée organoïde ou mini-organe, offrent sans avoir recours au modèle animal des perspectives prometteuses dans la modélisation in vitro de diverses pathologies comme le cancer par exemple. Désormais, le défi technologique que constitue l’utilisation des organoïdes comme véritable « avatar » du patient est de pouvoir les amplifier et les cultiver sur du long terme tout en préservant les caractéristiques du tissu d’origine ou de la tumeur primaire dans le cas des cancers.
Toutefois, bien que les CS et les organoïdes, soient connus pour être très sensibles à leur microenvironnement, l’absence de la prise en considération ou de la maitrise de ce dernier par les équipes de recherche constitue des contraintes fortes pouvant biaiser leurs résultats. Pour pallier à ce problème, les chercheurs ont donc besoin de trouver des conditions expérimentales (standardisées et plus robustes) permettant de cultiver leurs organoïdes sur du long terme tout en limitant les effets de dérive biologique.
Le projet NEXPOCAN servira donc de preuve de concept sur la faisabilité de générer des cultures d’organoïdes dérivées de patients de manière standardisées et plus fiables pour améliorer à court terme (1) le développement d’une médecine personnalisée plus efficace pour traiter les patients, mais aussi à plus long terme (2) le taux de succès dans le développement de médicaments antitumoral ouvrant ainsi la voie à la mise en place d’essais précliniques sans animaux.
PA : A quelle phase de votre recherche, le Prix (la dotation) intervient-il ?
NA : Le Prix Descroix-Vernier EthicScience 2023 arrive à une période charnière dans le développement du projet NEXPOCAN. En effet, nous validons actuellement à partir d’échantillons humains les dispositifs de culture que nous avons développés ainsi que les nouvelles conditions environnementales propices aux CS que nous avons identifiées. C’est un projet technologique qui par conséquent n’est pas facile à financer par les appels d’offres traditionnels et obtenir ainsi le Prix Descroix-Vernier EthicScience 2023 nous aidera à soutenir ce projet.

PA : La condition déterminante du Prix Descroix-Vernier EthicScience est de promouvoir et de récompenser des programmes hors modèle animal. Quelles ont été vos motivations, les raisons qui vous ont poussé à travailler à partir de méthodes substitutives à l’expérimentation animale ?
NA : Le développement de médicaments contre le cancer présente aujourd’hui un taux d’échec dramatique de l’ordre 96 % (dont plus de 90% lors du développement préclinique). Après un tel constat, Il est clair que les modèles animaux tels que la souris ne sont pas suffisamment prédictifs pour évaluer l’efficacité clinique des candidats-médicaments. Par conséquent, il était donc urgent pour nous d’établir de nouveaux modèles plus éthiques, robustes et fiables dans le but de modéliser plus fidèlement les caractéristiques morphologiques et moléculaires de pathologies comme le cancer.
PA : Avez-vous dû, à un moment de votre carrière, faire des expériences sur les animaux ? Si oui, quelles difficultés ou quels échecs avez-vous rencontrés ?
NA : Quand vous avions décidés de nous lancer dans l’optimisation de la technologie organoïde nous étions alors en plein confinement. Durant cette période, les patients n’étaient pas testés avant chirurgie contre la COVID 19. Par peur de contamination, il nous était donc formellement interdit de générer des organoïdes à partir d’échantillons humains. C’est pourquoi nous avions dû dans un premier temps travailler avec des organoïdes de souris qui malheureusement ne sont pas toujours représentatifs de la pathologie que nous voulons étudier, avec parfois même des réponses aux traitements qui peuvent être différents par rapport aux organoïdes humains.
PA : Dans quel contexte de la recherche (française, européenne, internationale), votre programme s’inscrit-il ? Quels sont les enjeux de votre projet ?
NA : En s’inscrivant dans une démarche de 3R (remplacer, réduire, raffiner), le projet NEXPOCAN repose sur le développement de nouvelles méthodes de culture cellulaire en 3D et s’inscrit donc dans une vraie volonté d’abolir à moyen terme l’utilisation du modèle animal dans la recherche. Ainsi, nous pensons que l’utilisation des modèles organoïdes humains sera accentuée dans les années à venir afin de répondre aux futures règlementations éthiques internationales. Cependant, par manque de robustesse, nous observons une certaine réticence de la part du secteur privé à utiliser cette nouvelle technologie. Le projet NEXPOCAN sera développé en étroite collaboration non seulement avec plusieurs entreprises du secteur de la santé mais également avec plusieurs plateformes nationales et internationales spécialisées dans le domaine de la culture cellulaire en 3D, ceci afin de permettre aux scientifiques du secteur public et privé de réaliser avec une plus grande reproductibilité des mises en culture d’organoïdes. Nous croyons ainsi que NEXPOCAN permettra d’accroître les performances et la fiabilité de la technologie organoïde et répondra aux attentes des entreprises pharmaceutiques afin que ces dernières puissent adopter en routine ce nouveau modèle alternatif à l’utilisation de l’animal.

Crédit image : Comité Pro Anima – Brett Walch Photography – Nicolas Aznar


