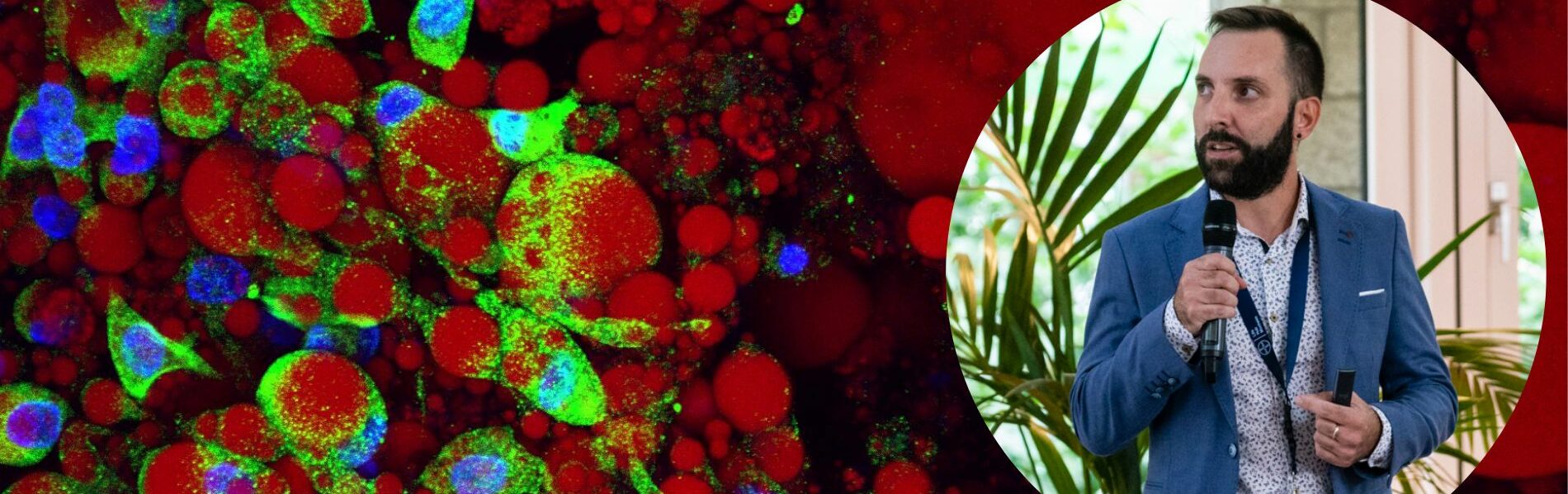
EXADEX-INNOV : Façonner le futur de la recherche préclinique ex vivo
Interview Dr. Vincent Dani
SES114 — Octobre 2024Vers des modèles cliniquement plus pertinents
Vincent Dani est cofondateur de la start-up française ExAdEx-Innov qui développe des technologies innovantes et brevetées autour du tissu adipeux humain. Outre ses compétences en tant qu’entrepreneur deeptech, Vincent possède un Doctorat en Biologie Cellulaire et Moléculaire de l’Université Côte d’Azur et une formation en gestion de la recherche clinique (formation CRA à la Faculté de Médecine de La Timone, Marseille).
Vincent Dani nous fait l’honneur de nous partager la particularité de son entreprise, unique au monde, et de son procédé technologique afin de développer des tissus humains adipeux ex vivo dérivés de patients.

Comité scientifique Pro Anima : Nous avons eu la chance d’échanger une première fois en octobre 2023 au sujet de vos travaux. Avant de revenir plus en détail sur les particularités de vos recherches, pouvez-vous, pour nos lecteurs, vous présenter, et nous parler de votre parcours jusqu’au lancement d’ExAdEx Innov ?
Dr Vincent Dani : J’ai eu un parcours académique assez classique : j’ai obtenu ma thèse en 2015 en physiologie cellulaire et biologie moléculaire, puis j’ai enchaîné plusieurs post-doctorats plutôt orientés recherche fondamentale, avec toujours ce désir d’utiliser les connaissances acquises dans l’”académique” pour développer des applications concrètes et utiles pour la société. En 2018, j’ai intégré en tant qu’ingénieur de recherche le laboratoire Cellules souches et Différenciation à l’Institut de Biologie de Valrose à Nice. Mon projet, soutenu par un organisme qui finance des projets académiques à vocation à donner des applications sur le marché, cherchait via les nouvelles techniques de culture cellulaire à développer des modèles 3D à partir de tissus adipeux humains. Très vite, on a réussi à développer un procédé qui nous a permis non pas de produire des modèles cellulaires 3D in vitro, mais de pouvoir cultiver directement du tissu adipeux humain ex vivo pendant plusieurs semaines.
Cette approche a rapidement été brevetée, dès 2019, avec le soutien des Sociétés d’Accélération du Transfert de Technologies (SATT) et on a commencé à avoir des demandes du marché, de sociétés qui percevaient les applications concrètes avec notre méthode pour le développement de leurs produits ou médicaments.
En 2022, nous avons ainsi décidé de créer la société EdAdEx-Innov. Nous sommes cinq cofondateurs, moi-même et Luigi Formicola, Bérengère Chignon-Sicard, chirurgienne, et deux chefs d’équipe académiques, Alain Doglio et Christian Dani. J’en ai pris la co-direction, notamment la partie scientifique, et mon collaborateur Luigi est en charge de la partie développement, marché et stratégie.
ExAdEx-Innov est incubée dans le laboratoire académique où s’est développée la technologie, sur le campus de la faculté de médecine. Ce qui est stimulant et assez original, c’est que nous sommes une société privée au milieu d’un environnement académique et hospitalier, ce qui nous permet de faire encore beaucoup de recherche et développement.
Comité scientifique Pro Anima : Pouvez-vous expliquer la technologie d’ExAdEx-Innov, en quoi cette plateforme de tissus adipeux dérivés de patients humains est-elle innovante et unique en France voire dans le monde ?
Dr Vincent Dani : La technologie brevetée est étonnamment assez simple, dans le sens où elle ne nécessite pas de dispositif particulier. Elle est néanmoins issue de plus de 30 ans de savoir-faire des équipes de recherche du laboratoire dans laquelle nous l’avons développée. Il s’agit d’un procédé qui nous permet de récupérer du tissu adipeux, donc de la graisse, directement de donneur(se)s sous forme de liposuccion ou d’abdominoplastie.
A partir de ces “déchets opératoires” qui sont en temps normal éliminés par le corps médical, nous avons réussi à développer un procédé qui permet de conserver le tissu en culture ex vivo, tout en conservant les réponses physiologiques via le micro-environnement, la vascularisation, la matrice, ainsi que les cellules immunitaires.
Huit semaines est la limite qu’on s’est fixée ; ceci, du fait qu’au bout d’un moment, les caractéristiques physiologiques commencent à être moins stables, voire à décliner [1]. En effet, nous n’avons pas un modèle de laboratoire classique qui s’homogénéise avec le temps, mais plutôt un modèle sans apports exogènes, donc sans biais, qui conserve la mémoire des donneur(se)s. Cette particularité est valable pour la graisse de ventre, de visage ou de cuisse avec lesquelles nous travaillons.
A partir de ce tissu conservé, on peut ainsi faire de la recherche fondamentale pour comprendre le fonctionnement de ce tissu adipeux, ou proposer cette technologie à des entreprises qui souhaitent développer des produits, des médicaments ou même des nouvelles techniques sans avoir à passer chez l’animal ou par des modèles d’organoïdes. Il s’agit d’un modèle humain beaucoup plus pertinent physiologiquement et cliniquement du fait de sa complexité. Notre procédé nous permet de nous situer au niveau tissulaire, ce qui constitue le point clé de cette innovation.
Le verrou technologique que nous avons levé est de dissocier la graisse non pas avec des enzymes ce qui nous mènerait à une culture cellulaire, mais de la dissocier de manière mécanique à travers des petits réducteurs. Ceci nous permet d’obtenir des structures plus petites que l’ordre normal qui est de plusieurs millimètres. Le tissu, “agressé” mécaniquement, va se régénérer à une taille qui va être fonctionnelle et compatible avec la culture et les échanges de milieux. Ce qu’on voit beaucoup avec des modèles cellulaires 3D de plus en plus gros et complexes est que le milieu ne pénètre pas au centre, ce qui mène à des corps nécrotiques (des amas de cellules mortes) [2].
On peut travailler dans différents contenants classiques de culture cellulaire, soit en condition “low” adhérence adapté à la culture 3D, soit en condition adhérentes grâce à une méthode d’encapsulation en agarose pour retrouver des conditions de culture conventionnelles, tout en maintenant les conditions d’une culture en suspension 3D.
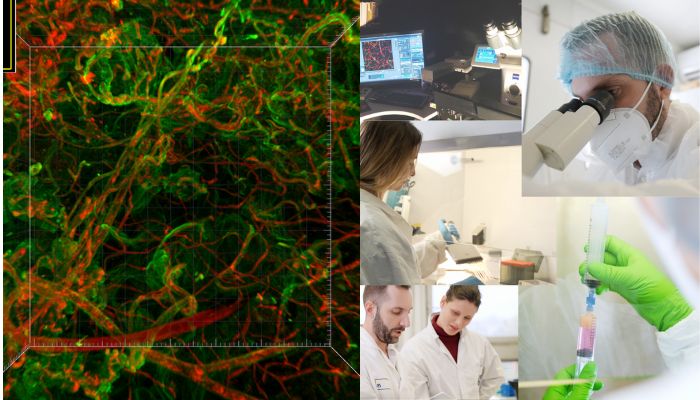
Comité scientifique Pro Anima : En terme de milieu de culture justement, Pro Anima s’intéresse beaucoup au sujet des biomatériaux et produits dérivés d’animaux, notamment l’ajout de sérum foetal de veau très couramment utilisé. Est-ce que vous avez un milieu de culture bien défini et qui est davantage adapté aux cellules humaines ?
Dr Vincent Dani : Tout à fait. C’est une très bonne question. Nous travaillions initialement avec un milieu commercial qui favorise la vascularisation, un milieu conçu pour les cellules endothéliales. Comme nous travaillons aussi sur des projets de biothérapies, nous devons avoir des milieux bien définis et connaître chaque produit contenu dans le milieu, sa composition et sa concentration.
Nous avons travaillé à réduire au maximum le nombre de composés différents dans le milieu, en essayant à chaque fois de manière empirique d’enlever un composé après l’autre, nous permettant de réduire ce milieu de culture au minimum nécessaire pour que le tissu s’auto-entretienne. Nous arrivons ainsi à cultiver le tissu adipeux sans sérum, dont les caractéristiques sont à peu près comparables à ce qu’on obtient avec l’ajout de sérum. L’explication biologique que nous avançons est qu’il s’agit d’un tissu assez complexe, avec de nombreux types cellulaires qui sécrètent eux mêmes leur propre facteur de croissance humain.
Nous avons développé ces milieux sans sérum pour la biothérapie, mais aussi à la demande de certains clients de l’industrie des cosmétiques qui souhaitaient avoir une culture non animale.
Ceci étant dit, nous n’utilisons pas tout le temps le milieu sans sérum, car pour l’instant, ça fonctionne quand même toujours mieux avec. Cependant, nous avons cette capacité de le faire aussi sans sérum si demain une réglementation interdisait l’utilisation de sérum animal, ou encore en cas de pénuries, et c’est une réelle question d’actualité, de savoir si on ne va pas en manquer à un moment donné.
De manière plus fondamentale, le fait de pouvoir retirer le maximum de composés dont le sérum, s’inscrit dans notre démarche de se rapprocher au plus près de ce qui se passe au niveau de la physiologie humaine, pour à la fois répondre aux demandes du marché, dans cette optique de réduire les intrants animaux, mais aussi pour la biothérapie où là, le niveau réglementaire exige qu’il n’y ait pas d’apports de produits animaux. Notre approche a donc été conduite autant pour l’aspect réglementaire que pour l’aspect éthique.
Comité scientifique Pro Anima : Les tests sur animaux pour les cosmétiques sont interdits en France et en Europe depuis 2013, avez-vous beaucoup d’interactions avec les acteurs de ce domaine et des succès avec votre plateforme à nous partager ?
Dr Vincent Dani : Oui, tout à fait. Le marché des cosmétiques a été le premier à s’intéresser à nos modèles ; ceci, notamment parce que nous avons développé nos modèles à partir de graisse du visage qui, pour la dermo-cosmétique particulièrement, était encore plus intéressant que de la graisse abdominale. Les modèles de graisse de visage sont beaucoup plus pertinents physiologiquement et cliniquement pour ces acteurs, la majorité des produits qu’ils développent étant justement pour des applications au niveau du visage, avec des anti-cernes, des anti-rides, etc.
Le message que nous partageaient ces entreprises, qui font beaucoup d’essais cliniques en allant tester leurs produits finaux sur des panels humains, était que les modèles cellulaires développés jusqu’alors ne suffisaient plus. En effet, la limite des modèles cellulaires est qu’il n’y a pas toutes les différentes couches et autres composantes de la peau. Or, il est important pour eux de pouvoir tester sur des modèles qui soient au plus proche de l’application finale dès les premières phases de développement. Nos modèles tissulaires conservent les réseaux vasculaire et lymphatique, et toute la matrice dont les protéines normalement présentes dans le tissu adipeux humain.
Les modèles cellulaires sont très bien pour tout ce qui est toxicité, mais ils sont moins pertinents pour démontrer le potentiel des actifs. Nous avons en ce sens un très bon exemple de la collaboration d’ExAdEx-Innov avec une société industrielle basée à Monaco qui développe des actifs (basés sur le silicium). En utilisant nos modèles de tissu adipeux, nous avons testé l’effet d’actifs cosmétiques au niveau global du tissu en regardant à la fois les effets sur la matrice, sur la vascularisation, sur le réseau lymphatique, et pas seulement sur la partie cellulaire qui compose le tissu. Ces travaux vont d’ailleurs être présentés au Congrès international de cosmétique qui aura lieu en 2024 au Brésil. Pour nous, il s’agit là d’un bel exemple à la fois sur le plan industriel et commercial, avec une société qui veut construire des histoires scientifiques derrière ses produits, démontrant qu’utiliser des modèles plus complets et plus proches de l’humain permet d’aller identifier des effets au niveau global.
Cet exemple montre également que les modèles alternatifs, comme ceux développés par ExAdEx, commencent à être visibles dans les congrès scientifiques, non pas (uniquement) en tant qu’alternative au modèle animal, mais car ce sont des modèles plus cohérents avec la physiologie humaine. Ce besoin de performance est important aussi au regard des enjeux économiques.
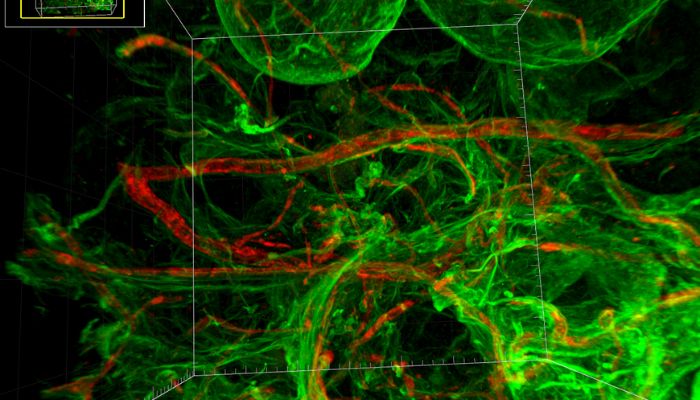
Comité scientifique Pro Anima : Quelles sont vos relations et votre expérience avec le secteur privé, académique, et les agences de régulation ? Dans quel(s) autre(s) domaine(s) que les cosmétiques votre approche peut-elle également présenter des applications concrètes et remplacer le modèle animal ?
Dr Vincent Dani : Le fait que nous soyons implantés au milieu de la recherche académique nous permet d’avoir encore beaucoup de projets intéressants avec des centres hospitalo-universitaires justement, et collaborer avec la recherche fondamentale ou la recherche clinique, en utilisant ces modèles plus physiologiques.
ExAdEx travaille beaucoup avec la médecine esthétique et régénératrice, mais aussi avec les groupes pharma qui commencent à s’intéresser à notre technologie ; en lien notamment avec l’adoption aux Etats-Unis du FDA Modernization Act 2.0, qui ouvre la voie au développement de médicaments sans passer par une phase sur les animaux. Probablement que le Canada devrait le faire prochainement ; espérons que ça donne de bonnes idées à l’Europe pour poursuivre en ce sens.
Un domaine pharmaceutique où le développement de nouvelles méthodes est conséquent est celui des traitements contre l’obésité et des maladies métaboliques. De nombreuses publications scientifiques démontrent que les modèles animaux, notamment la souris, ont un métabolisme ou une répartition des masses graisseuses totalement différent(e) de l’humain [3]. Nos modèles de tissu adipeux humain, récapitulant les différences de la population en termes d’indice de masse corporelle et de métabolisme, sont d’autant plus pertinents cliniquement, avec des réponses non biaisées contrairement à ce que l’on obtiendrait avec les modèles animaux.
Il y a beaucoup de médicaments où on voit des résultats positifs chez la souris mais qui, du fait de voies métaboliques et répartitions de graisses différentes, présentent une absence d’effet une fois testés chez l’homme.
Même si l’on peut encore à l’heure actuelle utiliser les animaux, il va y avoir un réel intérêt à ne plus les utiliser, non pas parce que la réglementation va le demander, mais plutôt parce que les nouvelles technologies sont plus pertinentes, tout simplement. Ce sont bien plus que des modèles alternatifs. Nous avons davantage intérêt à montrer aux entreprises pharmaceutiques mais aussi aux régulateurs que ces modèles ne sont pas seulement alternatifs, ils sont meilleurs et peuvent apporter des réponses plus fiables et plus représentatives au niveau clinique. Si cette démonstration est faite de manière systémique, le recours à l’expérimentation animale diminuera.
Et cela va pouvoir davantage se jouer à l’échelle européenne. Aux États-Unis, il semble y avoir une communauté importante ou qui commence à se créer relative à tout ce qui est modèles microfluidiques (MPS), ainsi que leurs validations. La même chose au niveau européen commence à se développer. De manière plus générale, des organismes comme le CEA, notamment qui portent beaucoup de voix au niveau européen, vont faire avancer les choses de ce côté là.
Comité scientifique Pro Anima : Lors de notre premier échange, vous nous aviez évoqué des problématiques d’accès aux tissus et/ou aux banques de données associées, est-ce toujours le cas aujourd’hui ? Quelle(s) solution(s) pourraient être selon vous mise(s) en place en France ou en Europe pour pallier le problème ?
Dr Vincent Dani : Je vais répondre à la question en deux temps.
Nous travaillons avec notre cofondatrice, le Dr Chignon-Sicard, à la mise en place d’un réseau de chirurgien(ne)s, avec le soutien du CHU de Nice. Ainsi, nous arrivons à avoir accès à du matériel humain via des donneurs, qui acceptent de mettre à disposition ce que l’on appelle leurs “déchets opératoires”. Il s’agit là d’un accès à un sourcing plus ou moins maîtrisé. On travaille aussi en collaboration avec le CHU de Nice pour déposer des demandes d’essais cliniques et ainsi avoir accès à du tissu adipeux de patients, cette fois-ci en situation d’obésité, pour développer des projets de recherche.
Ce que nous voyons aussi avec les collaborations d’ExAdEx-Innov, et avec notre présence au sein de consortia de recherche, est qu’avoir accès à des banques de données cliniques ou du matériel humain fait progresser la recherche de manière très significative. Ces données sont représentatives des différences au sein de la population, et permettent ainsi de répondre à des questions plus spécifiques et adaptées.
Nous travaillons pour notre part à congeler des tissus sans perdre les capacités physiologiques pour in fine élaborer des banques de tissus humains. Pour l’instant, ce n’est pas quelque chose que l’on a internalisé, parce qu’il y a toute une partie d’autorisations réglementaires pour constituer une banque d’échantillons. Mais cela reste une question difficile car en France l’accès à du matériel humain est très codifié, très encadré. Ce qui est bien et rassurant pour les patient(e)s ou pour les donneurs, il s’agit d’une garantie de la qualité des recherches. Et d’un autre côté, cet encadrement réglementaire étant exigeant, le processus est long.
La solution peut néanmoins se révéler assez simple, il s’agirait d’augmenter les moyens alloués à certaines instances et plus particulièrement aux Comités de Protection des Personnes (CPP) qui sont chargés d’émettre un avis préalable sur les conditions de validité de toute recherche impliquant du matériel humain.
En résumé, pour obtenir des déchets opératoires de patient(e)s deux cas se présentent : dans le cas d’une personne qui vient faire une liposuccion, son matériel biologique est normalement éliminé par le chirurgien et ne requiert pas d’opération supplémentaire. Ici, avec le consentement du donneur, on peut récupérer ce matériel avec des demandes administratives peu contraignantes
En revanche, si on veut récupérer du matériel humain dans le cadre d’une opération où normalement ce tissu n’est pas récupéré / éliminé, le chirurgien doit faire un geste opératoire supplémentaire. Dans un tel cas, il est nécessaire de passer par des demandes d’essais cliniques gérées par des comités à l’ANSM (Agence Nationale de Sécurité du Médicament et des produits de santé) et des CPP. Ces CPP vont évaluer la pertinence du projet, son intérêt scientifique, éthique, le risque que va prendre le patient de devoir subir un écart à l’opération pour laquelle il vient normalement, et valider ou pas le fait qu’il n’y a pas de risque pour le patient. Ce risque est le premier critère. S’il n’y a pas de risque, le CPP va évaluer la pertinence et les incidences scientifiques du projet qui fait l’objet de la demande.
Les CPP sont composés de chercheurs et professionnels, certes toujours dans l’activité de recherche avec un haut maintien du niveau d’expertise, mais qui sont bénévoles et reçoivent de nombreuses demandes. Ces évaluations prennent du temps. Ce temps, nécessaire, est aussi une garantie que le matériel biologique issu de donneurs ou de patients soit utilisé dans des projets qui en valent vraiment la peine ; ceci, pour que les prochains donneurs puissent être en confiance sur l’utilisation de leur matériel.
Toutefois, allouer davantage de moyens aux CPP permettrait que le processus et la décision d’autorisation soient plus rapides.
A titre d’exemple, notre demande d’accès à des tissus de patients obèses dans le cadre d’interventions de chirurgie bariatrique a pris presque un an, ce qui est très long.

Comité scientifique Pro Anima : Avez-vous rencontré des obstacles techniques ou sociaux dans le développement de votre start-up ?
Dr Vincent Dani : Non, pas forcément. Étant une innovation provenant de l’Université, nous avons été beaucoup soutenus au niveau local, par l’université Côte d’Azur et son programme d’excellence Idex, par les structures d’aide au transfert de technologies, que ce soit les incubateurs ou les pôles de santé. L’aide à l’innovation scientifique et de rupture en France est assez bien organisée. Pour en discuter avec d’autres entrepreneurs ou chercheurs au niveau européen, le système français est plutôt bien placé. Nous avons bénéficié, parmi d’autres subventions, de la bourse French Tech de BPI France.
Donc je dirais qu’il n’y a pas vraiment de verrous majeurs dans l’aide au développement des sociétés qui proposent des innovations scientifiques et de rupture. Après, le succès et la pérennité de ce type d’entreprises est la capacité à trouver une réelle demande de la part du marché ou du monde scientifique en général. Ainsi, les freins ne sont pas vraiment sociaux dans notre cas, mais plutôt davantage liés à la science qui nous dira si ce qu’on a développé est d’intérêt ou pas. C’est la particularité de nos sociétés que la BPI qualifie notamment de deeptech ; du fait que nous développons une innovation de rupture, nous façonnons le futur des modèles tissulaires. Comme nous sommes les premiers à faire ces modèles de tissus adipeux, nous créons en quelque sorte le marché, la demande et on essaie de montrer que ces modèles-là sont plus pertinents.
Comité scientifique Pro Anima : Auriez-vous envie de partager avec nous un ou plusieurs projets en développement et votre vision à long terme pour votre startup et pour la recherche biomédicale plus généralement ?
Dr Vincent Dani : Nous en avons un peu parlé tout au long de cette discussion, notre but chez ExAdEx est de développer des modèles qui soient plus proches de la physiologie humaine.
Dans cette optique, nous avons récemment eu un financement de l’Association Nationale de la Recherche et de la Technologie (ANRT) pour recruter une doctorante sous contrat CIFRE, dont l’objectif est de travailler à mieux comprendre comment fonctionnent les tissus adipeux de patients obèses.
C’est très difficile d’avoir des tissus adipeux pathologiques issus de patients en situation d’obésité. Ainsi, la solution que nous souhaitons développer est de recréer cet environnement pathologique avec des tissus sains obtenus à partir de déchets opératoires. Nous travaillons en collaboration avec une équipe de recherche spécialisée dans des techniques avancées de séquençage pour vraiment comprendre comment fonctionne la pathologie. Ceci nous permettra de recréer des modèles de recherche adéquats et de pouvoir tester des molécules, des médicaments dans un environnement qui soit physiopathologique et pertinent.
Notre doctorante a commencé en novembre dernier. Les premiers résultats, que je vous partage en exclusivité, sont que nous arrivons vraiment à reproduire en laboratoire quasiment la même inflammation qu’on observe chez les tissus adipeux de patients obèses, à partir de prélèvements de déchets opératoires de personnes “saines”.
C’est cet aspect qui constitue l’étape future. Proposer non pas des modèles qui recréent l’environnement normal d’un tissu, mais ses différentes dérivées d’états fonctionnels et physiologiques. Dans notre domaine, l’obésité est associée à des maladies métaboliques, notamment la maladie du foie gras, où le tissu adipeux pathologique va sécréter un certain nombre de composés qui vont rendre le foie en état inflammatoire. Nous commençons à développer des modèles pour comprendre les interactions qu’il y a entre le tissu adipeux et le foie. On le développe en interne, mais on peut aussi le développer avec des organismes de pointe dans le domaine de la microfluidique.
Il ne s’agit pas là d’une alternative aux expériences sur des souris qu’on a rendu obèses où le mécanisme est totalement différent. Une souris ne devient pas obèse comme un humain. Nous ne remplaçons pas les modèles animaux pour une question éthique mais pour des questions biologiques. Ce qui est le plus encourageant est que les sociétés qui viennent travailler avec nous cherchent un développement par la science. Ce n’est pas uniquement d’avoir un modèle alternatif, mais réellement d’essayer de mieux comprendre les mécanismes en ayant des modèles plus proches de la réalité clinique, faire plus de science et de la science plus pertinente. Notre mode de développement est vraiment poussé par le marché qui a envie d’être innovant et de trouver des solutions. Et il n’est pas uniquement poussé par un aspect marketing et commercial. Ça vient des deux côtés. C’est ça qui est stimulant.
Références
[1] « Regulation of Adipose Progenitor Cell Expansion in a Novel Micro-Physiological Model of Human Adipose Tissue Mimicking Fibrotic and Pro-Inflammatory Microenvironments », Vincent Dani et al. Cells 2022 Sep 7;11(18):2798.
[2] « Engineering organoids » Moritz Hofer and Matthias P. Lutolf, Nature Reviews Materials volume 6, pages402 – 420 (2021)
[3] « Of mice and men : Considerations on adipose tissue physiology in animal models of obesity and human studies » Ioannis G. Lempesis et al. Metabol Open. 2022 Sep ; 15 : 100208
En savoir plus
ExAdEx-Innov
Plateforme unique de R&D de tissu adipeux humain dérivé de donneurs ex vivo pour le développement de médicaments pharmaceutiques (obésité, maladies métaboliques chroniques), la recherche en dermo-cosmétique, nutraceutique, esthétique et chirurgie reconstructive.
ExAdEx-Innov détient les droits exclusifs mondiaux sur la technologie de rupture brevetée ExAdEx provenant de laboratoires académiques français d'excellence (Université Côte d'Azur, Institut de Biologie Valrose, CNRS, INSERM, CHU de Nice) et est soutenue par la SATT Sud-Est, l'IdEX Université. Côte d'Azur, CNRS Innovation, Incubateur d'entreprises Provence Côte d'Azur, Métropôle Nice Côte d'Azur et Accélérateur Eurobiomed Healthtech.
Credit : ExAdEx-Innov



