
Les perturbateurs endocriniens
Essayons d'y voir plus clair
Perturbateurs endocriniens : essayons d’y voir plus clair
Contribution du Dr. Jean-Pierre Cravedi, Toxicologue, ancien directeur de recherches INRAE
Points clés de cet article
- Les perturbateurs endocriniens (PE) imitent ou bloquent les hormones naturelles, affectant notamment les systèmes reproductif et thyroïdien et peuvent mener à des troubles de la fertilité et du développement, des cancers hormono-dépendants, et des maladies chroniques (diabète, troubles neuro-développementaux, etc.).
- Les PE se trouvent dans de nombreux produits du quotidien (alimentation, cosmétiques, emballages) et peuvent avoir un impact même à de faibles concentrations, particulièrement durant des périodes critiques (ex. périnatales).
- Les effets des PE peuvent apparaître tardivement et se transmettre à la descendance et l’exposition combinée à plusieurs PE peut amplifier leurs effets (dits effets cocktails).
- Les méthodes toxicologiques classiques actuelles sont insuffisantes pour évaluer pleinement les PE.
- Les défis dans l’évaluation des PE appellent au développement de tests non animaux à la fois plus rapides à mettre en œuvre et plus pertinents pour la santé publique.
L’hypothèse selon laquelle les substances chimiques auxquelles nous sommes exposés sont à l’origine de dysfonctionnements hormonaux et entraînent de ce fait des troubles de la santé a été largement évoquée dans le monde scientifique au cours des 30 dernières années et abondamment relayée dans les médias.
A l’origine, cette hypothèse repose majoritairement sur quatre types de travaux :
- Des observations sur les espèces sauvages montrant un lien de cause à effet entre l’exposition à une ou plusieurs substances chimiques et des effets sur la reproduction ou le développement, se traduisant, au final, par une réduction très significative des populations. C’est le cas par exemple des bulots de la mer du nord décimés dans les années 1980 par le tributyl-étain (la substance active des peintures antisalissures destinée aux coques des bateaux) ou encore des alligators mâles du lac Apopka en Floride en raison d’une forte exposition aux pesticides organochlorés (Tohmé et al., 20101).
- Les données recueillies sur les conséquences d’une exposition in utero à un estrogène de synthèse, le diéthylstilbestrol (DES). Ce médicament, prescrit aux femmes enceintes entre 1950 et 1977 pour prévenir les fausses couches et les complications de grossesse, a provoqué stérilité, cancer du vagin et de nombreuses anomalies utérines chez les jeunes femmes dont la mère avait reçu du DES durant la grossesse.2
- Les effets chez l’animal utilisé en laboratoire de substances capables d’interférer avec le système endocrinien et de provoquer un impact sur les fonctions de l’organisme régulées par ces hormones. Par exemple, de nombreux travaux menés chez le rat ont montré que certains phtalates tels que le di-butyl-phtalate, le butyl-benzyl-phtalate ou le diéthylhexylphtalate étaient capables de diminuer la production de testostérone (effet anti-androgénique), entraînant de ce fait des troubles de la fertilité et du développement.3
- Les études épidémiologiques tentant d’établir un lien entre l’exposition à une ou des substances chimiques et des troubles hormono-dépendants, tels que l’impact du Dichlorodiphényltrichloroéthane (DDT, polluant organique très stable et persistant) et de ses métabolites sur le développement ou la lactation ou encore des polychlorobiphényles (PCB) sur la fonction thyroïdienne.4
La combinaison de ces données initiales, acquises pour la plupart entre 1975 et 1990, a été à l’origine de la notion de perturbation endocrinienne en 1991 à l’occasion de la conférence de Wingspread (Wisconsin, Etats-Unis). Plusieurs milliers de publications scientifiques parues sur le sujet entre 1990 et 2010, en particulier sur l’impact sur la santé des perturbateurs endocriniens (PE) ont conduit l’Organisation Mondiale de la Santé (OMS) à les définir comme « une substance ou un mélange de substances, qui altère les fonctions du système endocrinien et de ce fait induit des effets néfastes dans un organisme intact, chez sa progéniture ou au sein de (sous)-populations. » Cette définition a été endossée par la Commission Européenne en 1999.
Comment agissent les PE ?
Le système endocrinien est basé sur un réseau de glandes endocrines, capables de produire des hormones, et de tissus cibles de ces hormones, répartis dans différents organes. Les hormones, qui sont pour l’essentiel transportées par la circulation sanguine, permettent une régulation fine de différentes fonctions de l’organisme telles que la reproduction, la croissance, le développement ou encore le métabolisme de l’organisme. Parmi les éléments du système endocrinien figurent en particulier l’hypothalamus, l’hypophyse, les glandes thyroïdes et parathyroïdes, les seins, le pancréas, les glandes surrénales, les ovaires, les testicules (figure 1).
Cet ensemble, à la fois complexe, multi-interactif et fragile, peut être perturbé par des substances extérieures à l’organisme et de ce fait entraîner des dysfonctionnements de ses fonctions essentielles. Historiquement, ce sont les œstrogènes et les androgènes (respectivement hormones femelles et mâles) qui ont fait l’objet des premières observations et qui ont abouti à la prise de conscience des scientifiques, des pouvoirs publics et plus largement des citoyens, de la nécessité de mieux connaître la perturbation endocrinienne. Depuis une dizaine d’années, d’autres hormones/cibles ont été explorées et ont conduit à élargir considérablement la problématique des PE. En particulier, de nombreuses publications ont fait état d’agents chimiques susceptibles d’avoir une incidence sur la fonction thyroïdienne, les régulations métaboliques ou encore le développement cérébral en interférant avec les hormones qui régulent ces équilibres.
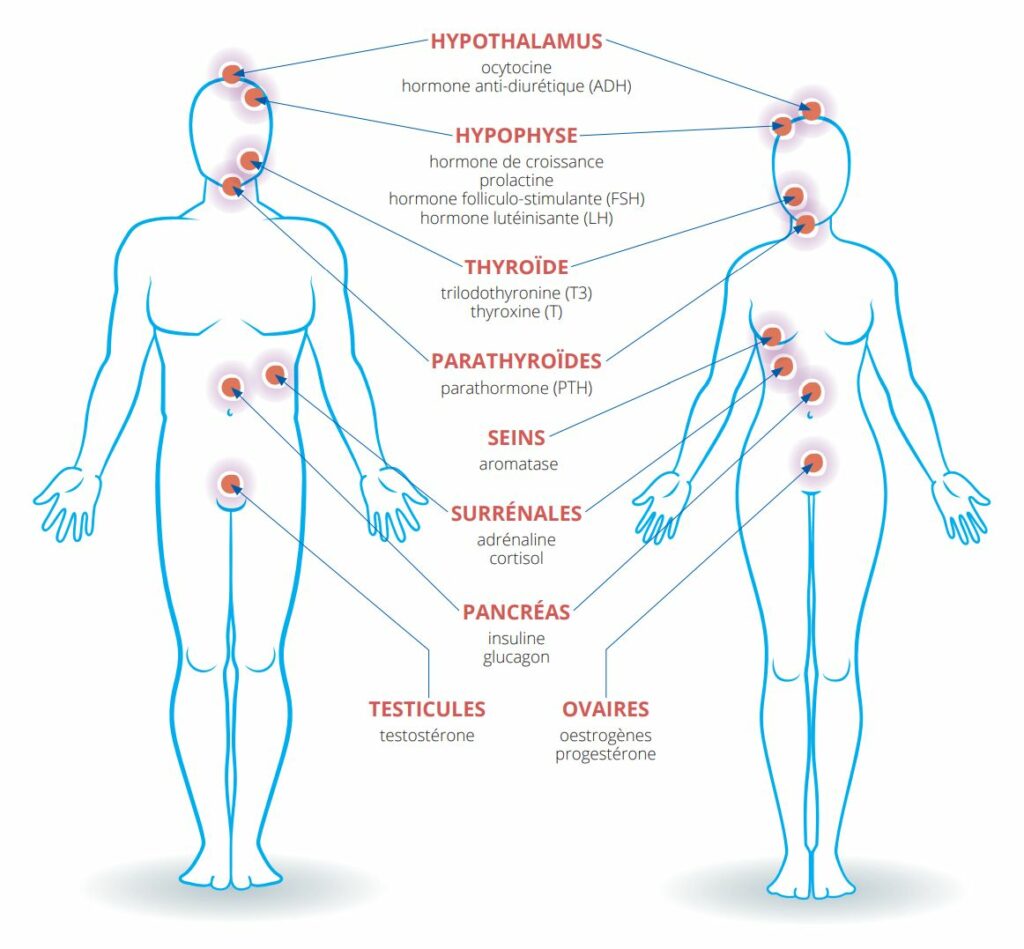
Figure 1 : Les systèmes endocriniens, masculin et féminin, et les principales hormones susceptibles d’être affectées par les perturbateurs endocriniens. Illustration inspirée de la Plateforme Pepper
La complexité de la problématique des PE repose non seulement sur la diversité des cibles concernées, mais également sur la multiplicité des modes d’action de ces substances. En effet, le mécanisme par lequel les hormones entraînent une réponse physiologique repose pour l’essentiel sur la liaison de l’hormone sur son ou ses récepteurs cellulaires. Ces récepteurs sont quelques fois comparés à une serrure dans laquelle l’hormone viendrait se loger en faisant office de clef et provoquer une action.
Dès lors, il est aisé d’imaginer qu’un PE peut interférer sur le système hormonal en se substituant à l’hormone véritable et en imitant son action. On parle alors d’un effet mimétique ou agoniste de la substance. Il est également envisageable, pour reprendre l’image évoquée plus tôt, que la substance vienne bloquer la « serrure », empêchant l’hormone de se fixer à son récepteur et rendant impossible son action. On est alors en présence d’un effet antagoniste de la substance.
Outre ces types de mécanismes via les récepteurs hormonaux, les PE peuvent également altérer la synthèse, le transport, ou encore la dégradation des hormones. L’ensemble de ces modes d’action est illustré dans la figure 2.
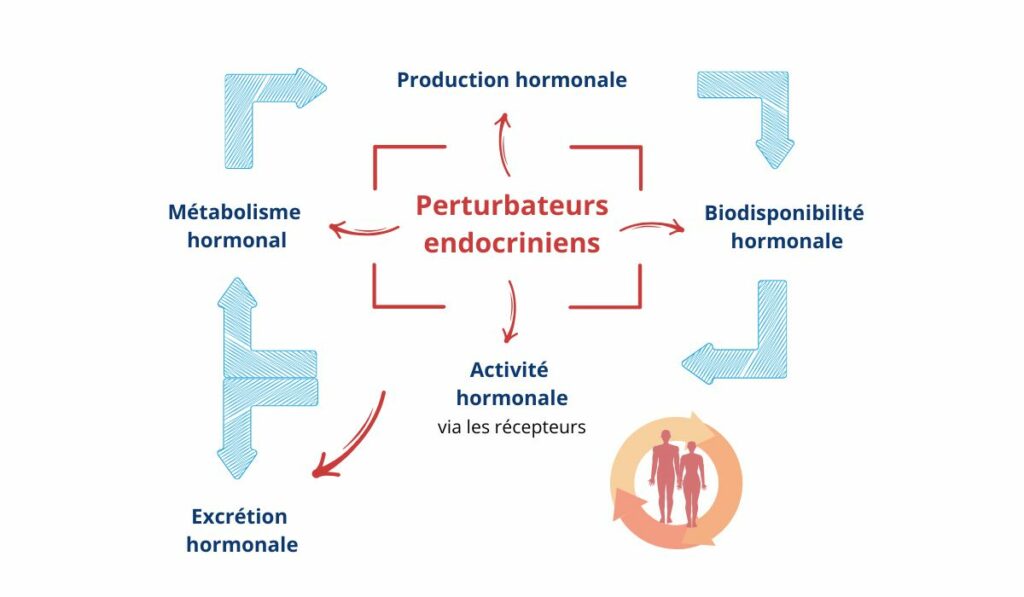
Figure 2 : Principaux modes d’action des perturbateurs endocriniens
Plusieurs facteurs ajoutent à la complexité de ces mécanismes et rendent délicate l’interprétation des données. En premier lieu, le fait qu’une même hormone puisse provenir de différents organes et agir sur des tissus cibles différents qui ne réagissent pas forcément aux mêmes doses circulantes représente une première difficulté. Par exemple, l’œstradiol, œstrogène principalement synthétisé dans les ovaires et qui est nécessaire au maintien de la fertilité et des caractères sexuels secondaires chez la femme est également produit dans le placenta et dans une bien moindre mesure dans les testicules. Il existe en outre non pas un mais plusieurs récepteurs aux œstrogènes qui ne conduisent pas aux mêmes effets, et enfin, ces récepteurs sont localisés dans différents tissus qui sont parfois sans lien direct avec les organes de la reproduction, ce qui complexifie la compréhension des mécanismes d’action de ces récepteurs et donc des substances susceptibles de les affecter.
Citons par exemple la présence de récepteurs aux œstrogènes dans l’intestin qui jouent sur sa perméabilité et par conséquent sur sa fonction d’absorption des nutriments et de barrière vis-à-vis des agresseurs biologiques et chimiques. Par ailleurs, pour rester dans le registre des composés œstrogénomimétiques, le bisphénol A (qui intervient dans la composition de certains plastiques ou résines) est capable de se lier aux récepteurs des œstrogènes et de ce fait, entraîner le même type de réponse que les hormones femelles, mais il peut également bloquer le récepteur aux androgènes c’est-à-dire celui qui répond aux hormones mâles telles que la testostérone.
Ces modes d’action multiples, parfois variables en fonction de la dose, sont loin d’être exceptionnels. Les PCB (polychlorobiphényles, autrefois majoritairement utilisés comme isolants électriques ou fluides caloriporteurs, mais toujours présents dans l’environnement et la chaîne alimentaire) agissant en tant que tels ou après avoir été transformés dans l’organisme, sont capables non seulement d’agir sur différents récepteurs hormonaux, mais également sur la synthèse, le transport ou la dégradation d’hormones telles que les hormones sexuelles, thyroïdiennes, surrénaliennes ou métaboliques.5
Quels sont les PE et où les trouve-t-on ?
Il est difficile de réaliser un inventaire des PE. Ils sont présents dans de nombreux objets et produits de la vie courante (détergents, produits ménagers, biocides, cosmétiques, produits alimentaires, emballages, matériels médicaux, jouets, etc.) et on en découvre de nouveaux en permanence.
Parmi les familles de produits les plus concernées, citons :
- Les pesticides : insecticides (ex : DDT, chlordécone, endosulfan, pyréthrinoïdes), herbicides (ex : atrazine, linuron, 2,4 D), fongicides (ex : bénomyl, manèbe, zinèbe, hexachlorobenzène, épiconazole)
- Les métaux lourds : cadmium, plomb, mercure
- Les produits utilisés en cosmétique : parabènes, benzophénones
- Les produits industriels : alkylphénols, bisphénols, phtalates, perchlorates, PFAS
- Les contaminants : dioxines, PCB, hydrocarbures aromatiques polycycliques
- Les substances naturelles : phytoestrogènes (ex : génistéine, coumestrol), mycotoxines (ex : zéaralénone)
Rappelons également que de nombreux médicaments tels que les contraceptifs ou certains anti-cancéreux et notamment ceux qui permettent de traiter les cancers hormono-dépendants sont nécessairement des PE puisque leur mode d’action intervient sur le système hormonal.
Que dit la réglementation ?
Bien que la prise en compte des PE soit apparue dès 2006 dans le règlement concernant l’enregistrement, l’évaluation et l’autorisation des substances chimiques en Europe (REACH), et qu’il en était fait mention dans la réglementation sur les produits phytopharmaceutiques en 2009 et sur les produits biocides en 2012, il a fallu attendre 2017 pour que soient définis les critères scientifiques pour la détermination des PE. Ces critères exigent (1) que la substance présente un effet néfaste (modification de la morphologie, de la physiologie, de la croissance, du développement, de la reproduction ou de la durée de vie d’un organisme) qui entraîne une altération de la santé ; (2) qu’elle ait un mode d’action endocrinien, c’est-à-dire qu’elle altère la ou les fonctions du système endocrinien ; (3) que l’effet indésirable soit une conséquence du mode d’action endocrinien.
Toutefois, il n’y a pas à proprement parler de liste officielle unique de l’ensemble des substances classées PE. Au sein de l’UE, plusieurs inventaires coexistent en fonction de la réglementation qui couvre ces produits. Citons par exemple, pour les substances qui rentrent dans le cadre du règlement REACH, la liste régulièrement mise à jour par l’Agence Européenne de Produits Chimiques (ECHA) et qui comprend à ce jour une douzaine de substances ou de groupes de substances classées PE en raison de leurs effets sur la santé humaine.6 Près de 150 substances ont été évaluées ou sont en cours d’évaluation par cette agence et plus d’une vingtaine d’entre elles ont été classées PE en raison de leur impact environnemental. D’autres listes concernant les produits phytosanitaires ou les biocides sont élaborées par les autorités compétentes.
En 2022, les PE font également leur apparition dans le règlement CLP concernant la classification, l’étiquetage et l’emballage des substances chimiques.
Les autorités nationales de Belgique, du Danemark, de France, des Pays-Bas, de Suède et d’Espagne ont pris l’initiative de regrouper sur un site unique les substances classées PE.7 Ces informations sont détaillées dans deux listes distinctes (Liste I et II), basées sur les règlements de l’UE pour REACH (enregistrement, évaluation, autorisation et restriction des produits chimiques), pour les produits biocides, pour les produits phytopharmaceutiques et pour les produits cosmétiques. Une troisième liste (Liste III) détaille les substances qui peuvent avoir des propriétés PE, et qui ont été proposées par une autorité nationale individuelle. En tant que telles, ces inclusions ne sont pas nécessairement soutenues par d’autres États membres de l’UE.
Notons également qu’en France, les PE ont fait l’objet de deux stratégies nationales (SNPE1 et SNPE2), visant notamment à réduire l’exposition de l’environnement et de la population à ces substances. Depuis 2022, toujours en France, la loi anti-gaspillage pour une économie circulaire (AGEC) impose l’information des consommateurs sur l’éventuelle présence de PE dans les produits mis sur le marché. Ces informations doivent être mises en ligne sur internet, en accès totalement public et libre de droit.
Quels sont les effets sur la santé ?
Une grande partie des études sur les PE ont tout d’abord mis en évidence des troubles de la fertilité et de la reproduction (baisse de la qualité du sperme, augmentation de la fréquence d’anomalies du développement des organes reproducteurs ou de la fonction de reproduction, abaissement de l’âge de la puberté), ainsi que des effets sur le développement, ou encore un impact sur les cancers hormono-dépendants, comme les cancers du sein ou de la prostate8. Plusieurs travaux ont également établi un lien entre perturbation endocrinienne et endométriose.9 Les données scientifiques plus récentes suggèrent qu’ils peuvent altérer le fonctionnement de nombreux autres organes et fonctions de l’organisme (altération du système immunitaire, troubles de la thyroïde, maladies hépatiques, etc…). Des troubles du neuro-développement comme l’autisme, la baisse de quotient intellectuel ou des troubles métaboliques comme le diabète ou l’obésité sont également suspectés d’être associés à une exposition aux PE10. Des atteintes de la physiologie osseuse, cutanée ou oculaire ont également été signalées11.
Néanmoins, le lien de cause à effet entre l’action d’un PE et ses effets néfastes chez la population générale est difficile à établir en raison du fait que les pathologies liées à la perturbation endocrinienne, généralement chroniques, sont pour la plupart multifactorielles.5 Santé publique France considère que 21 effets sanitaires des PE sont à surveiller en priorité.12 Parmi eux, six effets de la santé reproductive (cryptorchidie, hypospadias, puberté précoce, cancer du testicule, altération de la qualité du sperme et endométriose), auxquels s’ajoutent l’infertilité et la diminution de la fécondité. Ont également été retenus des effets métaboliques (surpoids et obésité, maladies cardiovasculaires, diabète de type 2 et syndrome métabolique), des troubles du neuro-développement de l’enfant (troubles du comportement, déficit intellectuel et troubles du déficit de l’attention), des cancers (cancer du sein, cancer de la prostate, lymphomes et leucémies chez l’enfant), et l’asthme.
La singularité des PE en matière d’évaluation du risque
Les PE ont quelques particularités qui justifient qu’ils occupent une place à part en matière d’évaluation du risque.
Tout d’abord, bien qu’ils ne soient pas les seuls dans ce cas, leurs effets peuvent survenir à de très faibles doses, ce qui n’est pas surprenant puisqu’ils miment souvent les hormones qui ont la propriété d’agir à d’infimes concentrations.
Ensuite, plus que la dose ou la durée, c’est la période d’exposition qui joue un rôle déterminant. La « fenêtre » d’exposition la plus sensible pour une majorité de PE est la période périnatale, c’est-à-dire celle qui couvre la vie fœtale et la petite enfance. Elle est à l’origine de la plupart des effets attribués à certains phtalates ou bisphénols, par exemple. La puberté est également une période de vulnérabilité vis-à-vis des PE.
Par ailleurs, conformément à l’hypothèse de Barker qui veut que ce qui se passe pendant le développement prénatal a un impact direct sur la santé et le développement de maladies chroniques à l’âge adulte, les effets des PE peuvent apparaître longtemps après l’exposition. L’exemple du DES cité plus tôt en est une illustration.
Au-delà de ces impacts différés, des travaux expérimentaux menés chez les rongeurs avec des PE tels que la vinchlozoline, un fongicide aujourd’hui interdit, le bisphénol A ou encore certains phtalates montrent que les effets observés chez l’individu exposé peuvent se transmettre sur plusieurs générations (effets multigénérationnels ou transgénérationnels). Les mécanismes impliqués sont probablement d’ordre épigénétique, c’est-à-dire font intervenir des modifications de l’expression des gènes sans changement de la séquence d’ADN.
La cinquième particularité concerne les courbes doses-réponses non monotones qui ont été mises en évidence dans plusieurs études expérimentales concernant les PE. Les toxicologues ont coutume de dire que c’est la dose qui fait le poison, en d’autres termes que les effets sont d’autant plus accentués que la substance toxique est administrée à de fortes doses. Lorsque l’on reporte ces résultats sur un graphique, on parle alors de courbe monotone qui permet de dériver aisément une dose sans effet et donc de proposer un seuil au-dessous duquel il n’y a pas de risque. En revanche, pour quelques PE, il peut arriver que des doses faibles aient des effets plus importants, voire opposés, à ceux de doses plus fortes, ce qui entraîne des courbes doses-réponses en forme de U ou en forme de U inversé et remet en cause les méthodes habituelles d’évaluation du risque. Toutefois, une analyse approfondie de la littérature scientifique menée par l’Autorité Européenne de Sécurité Sanitaire des Aliments (EFSA) et de plusieurs agences nationales d’évaluation du risque dont l’Anses pour la France, suggère que ce phénomène est davantage l’exception que la règle.13
Enfin, les « cocktails » de PE peuvent donner lieu à des effets synergiques ou potentialisateurs, c’est-à-dire que l’effet du mélange peut être supérieur à celui de chacune de ses composantes prises individuellement. Si cet effet n’est pas spécifique aux PE, il a été particulièrement mis en avant dans ce cas en raison des multiples cibles sur lesquels ils peuvent agir. L’exploration des mécanismes à l’origine de ces synergies a démontré que des interactions sont possibles au sein même des récepteurs sur lesquels les PE se fixent.14
Que sait-on de l’exposition humaine aux PE ?
Les PE sont abondamment répartis dans notre environnement. Dans la population générale, l’exposition peut se faire de nombreuses manières.
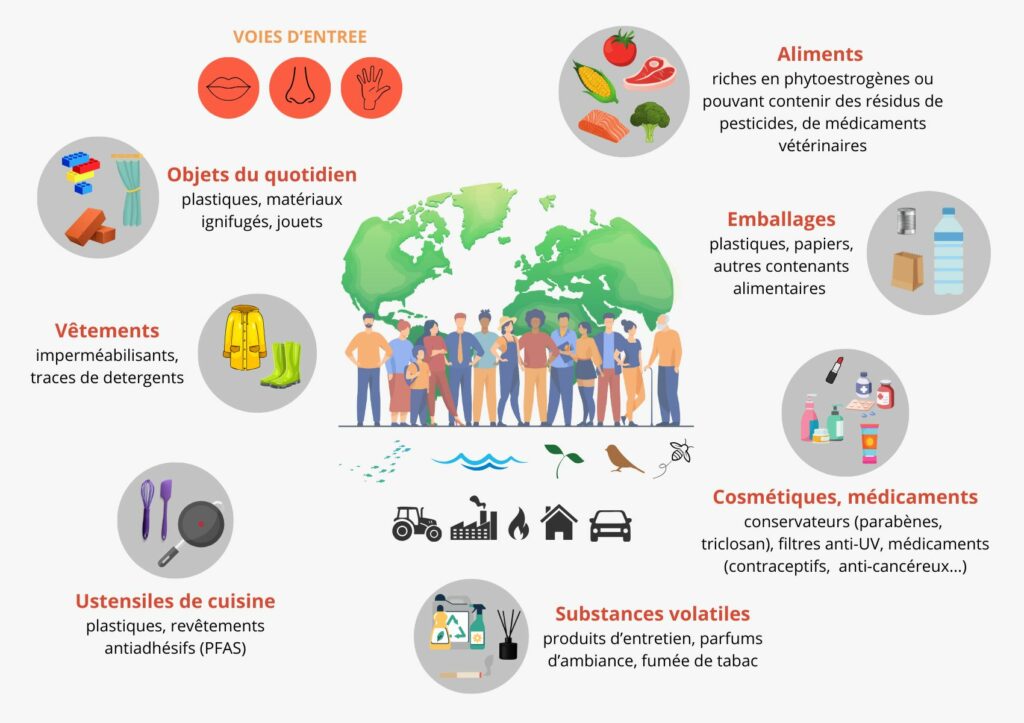
Figure 3 : Les perturbateurs endocriniens, des expositions multiples.
Les études d’imprégnation de la population montrent que les PE sont présents dans l’ensemble des enfants et des adultes chez lesquels des mesures de substances reconnues comme PE ont été mesurées.15
Quels sont les tests toxicologiques dont on dispose ?
Il existe une chaîne comportant une succession de tests normalisés par l’OCDE, classés en trois niveaux : tests in silico, tests in vitro et tests in vivo.16 Les tests in silico examinent la structure du produit et modélisent une liaison potentielle à un récepteur hormonal. Les tests in vitro permettent de mettre en évidence le mécanisme d’action : liaison à des récepteurs hormonaux, interaction avec les protéines de transport des hormones, ou encore effet sur la synthèse des hormones. Les tests in vivo, effectués souvent sur des rongeurs, consistent à rechercher des effets oestrogéniques, androgéniques, ou antagonistes sur les organes, les organismes et sur plusieurs générations. Il existe aussi des tests sur poissons et batraciens.
Ces tests, élaborés pour des applications règlementaires (ex : règlement REACH), présentent toutefois des limites, notamment au regard du nombre limité de cibles qui sont examinées. Si le processus de synthèse des hormones stéroïdiennes est bien pris en compte, les régulations hormonales considérées sont essentiellement celles régulées par les œstrogènes, les androgènes et les hormones thyroïdiennes. Ils restent par ailleurs incomplets par rapport à plusieurs aspects de la problématique des PE (effet des faibles doses, effets cocktails, fenêtre d’exposition).
En 2018, l’ECHA et l’EFSA, avec l’aide du centre commun de recherche de la Commission Européenne (JRC) ont publié un document guide relatif à l’identification des PE dans le cadre de la réglementation sur les biocides et les produits phytopharmaceutiques.17 Ce guide qui pourrait s’appliquer à d’autres substances que celles pour lesquelles il a été conçu, prend en compte dans sa démarche non seulement les tests règlementaires, mais également l’ensemble des données disponibles, dans une démarche du « poids de la preuve » (weight of evidence) concernant à la fois les modes d’action et les effets toxiques.
Plus récemment, l’agence américaine de protection de l’environnement (US-EPA) a publié un rapport montrant l’intérêt des nouvelles approches méthodologiques (NAM), c’est-à-dire accordant une large place à l’in silico, l’in vitro et la modélisation mathématique pour appréhender le risque associé aux PE.18
Il existe en outre de nombreux autres tests non standardisés, dont l’utilisation soulève la question de la fiabilité des résultats et de leur acceptation au niveau international. Il convient donc, à la fois d’accroître les efforts de recherche et de développement afin de disposer d’une batterie de tests couvrant mieux les nombreuses cibles potentielles des PE, mais également de s’assurer de la validité des méthodes mises en œuvre pour que les données produites puissent conduire à une meilleure évaluation du risque par les agences sanitaires.
CONCLUSION
En dépit des milliers de publications relatives aux PE, le risque qu’ils présentent en matière de santé publique reste difficile à évaluer. Une batterie de tests biologiques incomplète, une extrapolation animal-homme délicate, des données parfois discordantes chez les humains, rendent la mise en évidence d’un lien de cause à effet entre les données d’exposition et un éventuel dysfonctionnement hormonal malaisée. Une augmentation des troubles de la santé due aux PE est d’autant plus difficile à mettre en évidence que ceux-ci sont susceptibles d’apparaître plusieurs années ou décennies après une exposition pré- ou post-natale, à ces substances. Face à ce lot d’incertitudes, il existe néanmoins des évidences scientifiques notoires, des avancées réglementaires et de gestion du risque indiscutables, et des mesures de santé qui émergent et qu’il convient de saluer et de soutenir.
Un complément à cet article sera donné en 2025 et également publié en ligne et dans la revue pour explorer davantage les méthodes de tests ne recourant pas aux animaux, appliquées aux PE, abordant leurs enjeux et la manière dont ces méthodes pourraient répondre et/ou contribuer à lever certaines incertitudes sur les connaissances et évaluations actuelles.
Références
[1] Thomé M, Cravedi JP et Laudé V. Des polluants hormonaux, Pour la Science N°396 — octobre 2010.
[2] Fillion E, Torny D, un précédent manqué : le Distilbène® et les perturbateurs endocriniens. Contribution à une sociologie de l’ignorance, Sciences Sociales et Santé, Vol. 34, n° 3, septembre 2016.
[3] Silano V, Barat Baviera JM, Bolognesi C, et al. Update of the risk assessment of DBP, BBP, DEHP, DINP and DIDP for use in food contact materials. EFSA J. 2019 Dec 11;17(12):e05838.
[4] Cravedi JP, Narbonne JF. Données récentes sur l’évaluation des dangers liés à la présence de PCB dans l’alimentation, cité dans l’avis de l’AFSSA du 8 avril 2003. Décembre 2002.
[5] Les perturbateurs endocriniens, Actualité et dossier en santé publique n° 115, Haut Conseil de la Santé Publique (HCSP).
[6] Endocrine disruptor assessment list, ECHA (Last updated 08 novembre 2024).
[7] Endocrine disruptor list, The ED Lists.
[8] Darbre PD. The history of endocrine-disrupting chemicals. Current Opinion in Endocrine and Metabolic Research 2019, 7. pp. 26 – 33. ISSN 2451 – 9650.
[9] Dutta S, Banu SK, Arosh JA. Endocrine disruptors and endometriosis. Reprod Toxicol. 2023 Jan;115:56 – 73.
[10] Gore, AC., La Merrill, MA, Patisaul, HB, et al. Endocrine Disrupting Chemicals : Threats to Human Health. The Endocrine Society and IPEN. February 2024. ISBN # 978 – 1‑955400 – 23‑7.
[11] Shulhai AM, Palanza P, Street, ME. Current Evidence on the Effects of Endocrine-Disrupting Chemicals (EDCs) on Bone Growth and Health. Expo Health 16, 1001 – 1025 (2024).
[12] Vers un élargissement de la surveillance des effets sanitaires des perturbateurs endocriniens, Santé Publique France — décembre 2023.
[13] Beausoleil et al. Review of non-monotonic dose-responses of substances for human risk assessment. EFSA supporting publication 2016:EN-1027. 290pp
[14] « L’effet cocktail » des perturbateurs endocriniens mieux compris, INSERM Presse — janvier 2021.
[15] Perturbateurs endocriniens, Santé Gouv — Dernière mise à jour août 2024.
[16] Revised Guidance Document 150 on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption, OECD — September 2018.
[17] Guidance for the identification of endocrine disruptors in the context of Regulations (EU) No 528/2012 and (EC) No 1107/2009, EFSA — June 2018.
[18] EPA Rebuilds Endocrine Disruptor Screening Program by Soliciting Public Comment on New Approach Methodologies to Screen for Endocrine Effects, US EPA — January 2023.
A propos de l’auteur
Dr Jean-Pierre Cravedi
 Toxicologue, président du Conseil scientifique d’Aprifel, ancien expert de l’ANSES et de l’EFSA.
Toxicologue, président du Conseil scientifique d’Aprifel, ancien expert de l’ANSES et de l’EFSA.
Cet ancien directeur de recherche INRAE, a notamment dirigé l’UMR Xénobiotiques, à Toulouse, avant d’être chef de département adjoint pour le département Alimentation Humaine de 2014 à 2019. Ses travaux l’ont conduit à étudier le devenir et les effets de plusieurs contaminants présents dans l’environnement ou dans l’alimentation, dont les perturbateurs endocriniens.
Dr Jean-Pierre Cravedi est également depuis 2025 président du comité stratégique du Prix Descroix-Vernier EthicScience.
- Thomé M, Cravedi JP et Laudé V. Des polluants hormonaux, Pour la Science N°396 — octobre 2010.
- Fillion E, Torny D, un précédent manqué : le Distilbène® et les perturbateurs endocriniens. Contribution à une sociologie de l’ignorance, Sciences Sociales et Santé, Vol. 34, n° 3, septembre 2016
- Silano V, Barat Baviera JM, Bolognesi C, et al. Update of the risk assessment of di-butylphthalate (DBP), butyl-benzyl-phthalate (BBP), bis(2‑ethylhexyl)phthalate (DEHP), di-isononylphthalate (DINP) and di-isodecylphthalate (DIDP) for use in food contact materials. EFSA J. 2019 Dec 11;17(12):e05838.
- Cravedi JP, Narbonne JF. Données récentes sur l’évaluation des dangers liés à la présence de PCB dans l’alimentation, cité dans l’avis de l’AFSSA du 8 avril 2003. Décembre 2002. Disponible sur www.afssa.fr
- https://www.hcsp.fr/explore.cgi/adsp?clef=1176
- https://echa.europa.eu/fr/ed-assessment
- https://edlists.org/
- Darbre PD. The history of endocrine-disrupting chemicals. Current Opinion in Endocrine and Metabolic Research 2019, 7:26 – 33
- Dutta S, Banu SK, Arosh JA. Endocrine disruptors and endometriosis. Reprod Toxicol. 2023 Jan;115:56 – 73.
- Gore, AC., La Merrill, MA, Patisaul, HB, et al. Endocrine Disrupting Chemicals : Threats to Human Health. The Endocrine Society and IPEN. February 2024. ISBN # 978 – 1‑955400 – 23‑7
- Shulhai AM, Palanza P, Street, ME. Current Evidence on the Effects of Endocrine-Disrupting Chemicals (EDCs) on Bone Growth and Health. Expo Health 16, 1001 – 1025 (2024). https://doi.org/10.1007/s12403-023 – 00607‑3
- https://www.santepubliquefrance.fr/les-actualites/2023/vers-un-elargissement-de-la-surveillance-des-effets-sanitaires-des-perturbateurs-endocriniens
- Beausoleil et al, 2016. Review of non-monotonic dose-responses of substances for human risk assessment. EFSA supporting publication 2016:EN-1027. 290pp
- https://presse.inserm.fr/leffet-cocktail-des-perturbateurs-endocriniens-mieux-compris/41920/
- https://sante.gouv.fr/sante-et-environnement/risques-microbiologiques-physiques-et-chimiques/article/perturbateurs-endocriniens
- https://www.oecd.org/en/publications/guidance-document-on-standardised-test-guidelines-for-evaluating-chemicals-for-endocrine-disruption-2nd-edition_9789264304741-en.html
- https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/j.efsa.2018.5311
- https://www.epa.gov/pesticides/epa-rebuilds-endocrine-disruptor-screening-program-soliciting-public-comment-new


